Volker Moennig1 y Matt J. Yarnall2
1. Institute of Virology, University of Veterinary Medicine Hannover, 30559 Hannover, Alemani
2. Boehringer Ingelheim Vetmedica GmbH, 55218 Ingelheim am Rhein, Alemania
1. Introducción
La historia conocida de la diarrea viral bovina (DVB) comenzó en 1946, cuando se notificó una nueva diarrea transmisible[1]. Aparte de la diarrea aguda, en ese momento, no se conocía ningún otro daño particular causado por la infección. Sin embargo, la verdadera naturaleza de la infección se fue descubriendo progresivamente. Costó al menos 40 años descubrir el verdadero impacto de las infecciones por el virus BVD (BVDV). Hoy en día, la BVD es reconocida como una de las enfermedades endémicas del ganado de mayor importancia económica.
A excepción de los poco comunes brotes de BVDV virulento[2], que pueden matar hasta el 40 % de los terneros, la BVD es una enfermedad sigilosa que suele pasar desapercibida para el ganadero. El BVDV está bien adaptado al ganado y, en la mayoría de los casos, aparte de algunos días de fiebre y pérdida de apetito, no hay signos clínicos de infección aguda, que termina después de unas dos o tres semanas y deja a los animales inmunes a la reinfección. Sin embargo, la infección aguda siempre va acompañada de inmunosupresión transitoria, lo que facilita las infecciones secundarias por patógenos oportunistas y tiene un impacto tremendo sobre la fertilidad de las hembras. Sólo unos meses después de la introducción de la infección en el rebaño, aparecen efectos visibles que el ganadero rara vez asocia con BVD. Los fallos reproductivos, por ejemplo, la infertilidad transitoria, los mortinatos, los abortos, los terneros con malformaciones y los terneros persistentemente infectados (PI), generalmente son causados por la infección por BVD. Los terneros PI son el impulsor epidemiológico clave de BVD y resultan de la transmisión del biotipo BVDV no citopático a través de la placenta de madres naïve durante los primeros 18 a 120 días de gestación. La mayoría muere a una edad temprana, pero algunos desarrollan un cuadro clínico grave de enfermedad fatal de las mucosas, tras una superinfección con el biotipo citopático de la misma composición antigénica del BVDV[3,4]. Aproximadamente la mitad de los animales IP parecen clínicamente normales y su infección solo puede detectarse mediante métodos de diagnóstico laboratorial. Otros efectos de la infección son la reducción de la salud del rebaño, por ejemplo, disminución de la producción de leche, mastitis clínica, intervalos entre partos más prolongados y un aumento de las enfermedades respiratorias y entéricas[5]. La mayoría de estos últimos efectos son atribuibles a la inmunosupresión transitoria por la infección por BVD.
Se han hecho multitud de intentos para evaluar el daño económico infligido por las infecciones por BVD[6,7]. Los resultados son bastante heterogéneos según los diseños del estudio. Por ejemplo, el tipo de rebaño, los parámetros para calcular las pérdidas y las condiciones específicas del país. Sin embargo, existe un consenso general de que la BVD causa daños económicos considerables y la mayoría de los países que han realizado los respectivos análisis económicos han desarrollado programas para la mitigación y el control de la BVD. En este documento, el término control se usa, principalmente, para programas en curso y pasados en lugar de erradicación, porque este último significa la eliminación total (100%) y permanente de la infección por BVD, lo que en la actualidad no siempre es posible.
2. Programas de Control Temprano
Hasta finales de la década de 1980, se pensaba que un control eficaz de la BVD era imposible, tanto por la distribución ubicua de la infección como por la falta de pruebas diagnósticas de laboratorio económicas y eficaces. Además, debido a la naturaleza sigilosa de la enfermedad, los ganaderos y veterinarios aún no habían apreciado el alcance total de su daño económico. Posteriormente, el desarrollo de pruebas serológicas y de detección de antígenos rápidas y económicas[8] basadas en técnicas ELISA proporcionaron herramientas adecuadas para el diagnóstico de BVD a gran escala a nivel regional y nacional. Sin embargo, además de los medios técnicos para detectar infecciones por BVD, la concienciación de todas las partes interesadas y las disposiciones financieras y legales son esenciales para el diseño y la implementación de un programa de control. El primer programa regional de control voluntario se lanzó a fines de la década de 1980 en el estado de Baja Sajonia en Alemania[9]. Dado que los fondos eran limitados y la concienciación de los ganaderos, en general, aún era baja en ese momento, las medidas de control fueron de carácter voluntario. El elemento clave del programa fue la búsqueda de animales IP utilizando muestras de sangre. Los ganaderos que se inscribieron en el programa recibieron una compensación por los animales PI sacrificados y se les pagaron las pruebas de laboratorio. Pronto, quedó claro que las explotaciones participantes, una vez libres de BVD, se enfrentaban un alto riesgo de reinfección proveniente de explotaciones vecinas infectadas y, por lo tanto, la vacunación gratuita de rebaños libres de virus se convirtió en parte del programa. Para los ganaderos participantes, el programa resultó bastante exitoso, pero debido a la falta de una participación más amplia de las partes interesadas, no redujo significativamente la prevalencia regional de BVD. Debido a la larga duración del enfoque voluntario, los costes fueron muy altos y no se pudo lograr un efecto sostenible sobre la prevalencia de BVD.
Al mismo tiempo, los países escandinavos iniciaron programas obligatorios de control de BVD[10]. Se prohibió la vacunación y, mediante serología, se identificaron los rebaños infectados, con una intensa búsqueda de animales PI en los rebaños positivos. El ganado PI tuvo que ser sacrificado y se establecieron restricciones de movimiento para los rebaños infectados. La bioseguridad fue estricta. Algunos programas fueron impulsados inicialmente por la industria, pero en las etapas finales todos fueron apoyados por los respectivos gobiernos. Después de unos 10 años, los países escandinavos estaban prácticamente libres de BVD. Los análisis de costes y beneficios mostraron los efectos económicos favorables de las medidas[11]. Unos años más tarde, Austria siguió con éxito el método escandinavo de control de BVD[12]. El enfoque escandinavo demostró claramente que el control sistemático de la BVD es posible y que tiene efectos positivos, por ejemplo, mejora la salud del rebaño y el bienestar animal, mejores resultados reproductivos, mayor producción de leche, mejores precios para el ganado selecto, uso reducido de antibióticos y, por último, pero no menos importante, menor gasto veterinario.
3. Programas de control actuales
3.1. El papel de las partes interesadas
Durante los primeros programas de control, se hizo evidente que la participación de las partes interesadas es crucial. Este fue el enfoque principal de los primeros Congresos BVDzero, que reunió a partes interesadas de todo el Reino Unido e Irlanda. El evento de 2021 se llevó a cabo virtualmente debido a las restricciones de moviemiento a causa del coronavirus, lo que facilitó la participación a nivel mundial. Se utilizó una plataforma específica de participación de video (Livestorm ® , Woburn, MA, EE.UU.) para organizar el Congreso en vivo, que consistió en cuatro talleres para que participaran las partes interesadas.
Las partes interesadas se registraron antes del evento, que se llevó a cabo el 7 de julio de 2021, con 327 usuarios registrados de 28 países. Las presentaciones pregrabadas para proporcionar un contexto que fomentara el debate estuvieron disponibles para ser visionadas por siete oradores, que representaron a siete programas diferentes en el camino a la erradicación de la BVD. Los ponentes fueron Javier Diéguez, Universidad de Santiago de Compostela, en representación del programa de control de BVD de Galicia; Neil Shand, director ejecutivo de la Asociación Nacional de Carne de Vacuno del Reino Unido, en representación del programa inglés de erradicación de la BVD; Neil Paton, Royal Veterinary College London, en representación del programa de erradicación de Gales BVD; Jenny Purcell, gerente de políticas de BVD para el gobierno escocés, en representación del programa escocés de erradicación de la BVD; Maria Guelbenzu, directora del programa BVD en representación del programa de erradicación de Irlanda; Jörn Gethmann, Friedrich-Loeffler-Institute, en representación del programa de erradicación alemán; y Matthias Schweizer, Universidad de Berna, en representación del programa suizo de erradicación de BVD. Estas presentaciones están disponibles en www.bvdzero.co.uk/blog/bvdzero-congress2021 (consultado el 3 de octubre de 2021).
Los cuatro talleres fueron organizados por oradores que representaban a un programa de erradicación, y las partes interesadas contribuyeron con preguntas en una plataforma de colaboración visual en línea (Miro ® , San Francisco, LA, EE.UU.). Hubo 116 participantes entere las partes interesadas que participaron en vivo durante el 50% o más del evento. A continuación se muestra un resumen de las respuestas a las preguntas planteadas.
3.1.1. ¿Cómo iniciar un programa de control local o erradicación?
Durante las exposiciones se citó la importancia de disponer de soporte financiero y de una buena base datos al comienzo del programa; sin embargo, no se citaron con tanta frecuencia como la necesidad de un programa simple que se vincule con otras actividades o programas de control de enfermedades y garantice la máxima participación de las partes interesadas. Otros factores mencionados fueron asegurar el compromiso personal con los ganaderos y hacer uso de un elemento competitivo, con objetivos y comunicación claros. Algunas partes interesadas con experiencia en programas de erradicación sugirieron que el marcado de orejas desde el principio sería beneficioso, junto con incentivos que garanticen la eliminación de los PI. Los mensajes para llevar a casa para aquellos que inician un programa de control de BVD fueron establecer objetivos realistas, comunicar bien, disponer de un programa simple y consistente, y respaldar todo este esquema con legislación.
3.1.2. ¿Quienes son las partes interesadas a identificar para participar en la erradicación de la BVD y cómo se puede optimizar la participación temprana?
Las partes interesadas abarcan toda la industria, desde los consumidores hasta las empresas de gestión de datos, y desde los gobiernos hasta los ganaderos y las organizaciones ganaderas. Las razones para la participación temprana incluyen percibir en la productividad y los beneficios para la salud, un sentido de bien público y orgullo, así como la presión dentro y fuera de la industria. Las barreras para ese compromiso temprano son los costes iniciales o los costes percibidos, la priorización de otras enfermedades y el tiempo adicional requerido. Cuando se preguntó qué recursos y capacidades podrían aportar las partes interesadas para optimizar la participación temprana, hubo un fuerte apoyo para el respaldo del gobierno, incluida la legislación y la financiación. Una base de datos y la transparencia sobre el estado de la enfermedad también son importantes, junto con cualquier otro incentivo que las partes interesadas pudieran brindar.
3.1.3. ¿Cómo se puede mantener el entusiasmo de las partes interesadas a lo largo del proceso de erradicación de la BVD?
Las partes interesadas destacaron que la comunicación clara del programa, desde el principio hasta el final y la evidencia del progreso temprano son fuertes motivadores, junto con compartir experiencias y evidencia de los beneficios de la erradicación. La presión del mercado, por ejemplo, compradores de ganado selecto, cadenas de supermercados y consumidores, también son un elemento motivador. Sin embargo, las campañas prolongadas y la falta de progreso visible se consideraron como los principales desmotivantes. La falta de cumplimiento por parte de otras partes interesadas y las prioridades puestas en otras enfermedades también se consideraron desmotivantes. También se destacó el coste inicial, especialmente cuando el impacto de la enfermedad no es obvio. Finalmente, la complejidad del programa fue un desmotivador comúnmente citado.
3.1.4. ¿Cómo se determina la consideración de libre de BVD y tiene cabida la vacunación?
Las partes interesadas enfatizaron los beneficios del control de la BVD a través de la mejora de la salud, el bienestar y la productividad del ganado, incluido el uso reducido de antimicrobianos. Sin embargo, también hubo algunos beneficios que históricamente han sido menos considerados, incluida una mayor confianza para erradicar o controlar otras enfermedades y una mejor salud mental de los ganaderos. El cambio se considero a un sistema de vigilancia como un riesgo potencial para mantener la ausencia de BVD, ya que es posible que no se garantice la detección rápida de nuevos brotes de BVDV. La apatía de la industria y las explotaciones que no cumplen, una falsa sensación de seguridad que conduce a medidas de bioseguridad menos estrictas y una cabaña naïve se mencionaron como dificultades importantes para los programas de control. Las medidas propuestas para minimizar estos riesgos fueron un régimen estricto y continuo de vigilancia de los rebaños, un rastreo rápido de nuevos casos utilizando una base de datos, así como controles fiables de importación. Esto debe estar respaldado por una legislación apropiada y podría combinarse en áreas de mayor riesgo con la vacunación continua para mantener la inmunidad colectiva.
3.2. Avances recientes
Durante los últimos 25 años, los primeros enfoques para el control de la BVD (voluntario y obligatorio, con y sin vacunación) sirvieron como modelo para una serie de programas de control regionales y nacionales, que se están aplicando en varios países europeos para la mitigación o el control de la BVD. Sin embargo, existen algunas diferencias entre los programas, las herramientas de control se utilizan en varias combinaciones y la participación de las partes interesadas varía. El Congreso BVDzero destacó la situación en siete regiones y países europeos. Más allá de estos programas, hay esfuerzos de control en camino en otros países europeos y fuera de europa[13].
Suiza, Alemania, Irlanda y Escocia implementaron recientemente variaciones de los programas escandinavos. En países con alta seroprevalencia y/o vacunación generalizada, la detección directa del virus fue el método de elección en lugar de la vigilancia serológica. Con una seroprevalencia del 87%, la BVD era endémica en Suiza cuando el país lanzó una operación de control masivo al realizar pruebas de BVDV en la cabaña bovina nacional en 2008. En los cuatro años siguientes, se analizó a todos los terneros recién nacidos y la prevalencia de PI fue decayendo del 1,3% al 0,02%. Posteriormente, después de cinco años de detección del virus, se introdujo la vigilancia serológica utilizando muestras de suero o leche del tanque. Una base de datos nacional de movimientos de animales y la secuenciación parcial del ARN viral resultaron de utilidad, especialmente en las últimas etapas del programa, cuando había que rastrear el ganado PI individualmente hasta su origen y contactar con las explotaciones[14]. Ocasionalmente, la causa de la seropositividad podría atribuirse a contactos con pequeños rumiantes[15]. Se demostró que los rumiantes salvajes no son un reservorio del virus BVD[16]. Esto último está en línea con los resultados de otros países europeos[17]. Hoy en día, todavía hay algunos, aunque muy pocos, rebaños restringidos en Suiza, y se cree que la vigilancia deberá continuar durante mucho tiempo. Las debilidades del enfoque suizo fue la organización de control cantonal en lugar de federal, la ganadería alpina, el uso indebido en parte de la base de datos nacional y un rastreo poco consistente[18]. La vacunación estuvo prohibida durante todo el programa.
Por el contrario, la vacunación como herramienta de control suplementaria se utilizó en Alemania, Irlanda y Escocia. Tras el primer programa de control voluntario regional, la mayoría de los estados federales alemanes lanzaron sus propios programas voluntarios. Según la densidad del ganado y la estructura de la industria, las disposiciones variaban y la vacunación se prohibía o se utilizaba como una herramienta de control adicional. En 2004, la BVD pasó a ser notificable y en 2008 se promulgó una legislación nacional para el control obligatorio de BVD. Tres años después, en enero de 2011, entró en vigor[19]. La búsqueda de animales PI se realizó utilizando muestras de sangre de animales adultos y muestras de muesca de oreja de terneros recién nacidos. Los resultados de los diagnósticos de laboratorio se introdujeron en la base de datos nacional de ganado. Los animales PI tuvieron que ser retirados inmediatamente y se impusieron restricciones comerciales durante 40 días. El comercio de animales preñados se suspendió hasta el nacimiento y la obtención de un resultado negativo de la descendencia. Dependiendo de la situación epidemiológica local, se podría ordenar o prohibir la vacunación. El programa fue muy exitoso. En su transcurso, se testaron más de 50 millones de bovinos y se retiraron 49.000 animales PI. La prevalencia actual de PI es del 0,005 %. Actualmente, el programa de control está siendo revisado; se prohibirá la vacunación y Alemania solicitará el estatus de “libre de BVD”. En retrospectiva, el programa de control fue beneficioso para la industria ganadera, pero fue costoso. Las simulaciones muestran que aún podría haber un riesgo de una línea de base futura de animales PI.
El programa de control irlandés se lanzó en 2013 y ahora se encuentra en sus etapas finales, con 230 rebaños bajo restricción en 2021. El objetivo es estar libre de BVD en 2023. Al igual que con programas de control similares, el final de una campaña de control de BVD requiere un control más estricto para alcanzar el estatus de libre de la enfermedad. El aumento de la vacunación financiada por el gobierno se está utilizando para cortar nuevas infecciones en granjas naïve. Desde el principio la retención de animales PI aparentemente “sanos” supuso un problema. Muchos ganaderos intentaron engordar y vender estos animales. La disminución del cumplimiento al final del programa también se considera como un problema.
Escocia inició en 2010 un programa voluntario de control de BVD dirigido por la industria con la financiación de medidas de detección. Todas las acciones fueron guiadas desde el principio por un grupo asesor sobre BVD. En 2013, el control de los rebaños de ganado pasó a ser obligatorio y en los años siguientes se intensificó el control y se implementaron restricciones de movimiento. Los animales reproductores importados tenían que someterse a pruebas. Se está utilizando una base de datos para facilitar el seguimiento de los animales positivos. El endurecimiento gradual de las medidas a lo largo de los años ha tenido éxito y, en la actualidad, alrededor del 90 % de los rebaños de cría escoceses están libres de BVD. Los rebaños no reproductores y los animales importados fueron un desafío para el programa porque los esfuerzos se concentraron demasiado en los rebaños reproductores.
En la actualidad, varios programas voluntarios están en marcha, por ejemplo, en Gales, Inglaterra y Galicia en España. Este último programa, que está subvencionado por el gobierno regional, se inició en 2004. Se basa en la serología y la detección de PI. En los rebaños infectados, se analizan todos los terneros recién nacidos y los animales positivos están sujetos a restricciones de movimiento. Los rebaños participantes se clasifican (0–3), siendo el nivel 3 libre de BVD. Galicia es una región densa en ganado, y se observó que el progreso se está desacelerando con los años. El gobierno tiene la intención de extender el programa a todas las granjas de Galicia, lo que equivaldría a un programa obligatorio dirigido por el gobierno.
Otro programa voluntario (BVD-Free) se lanzó en Inglaterra en 2016. Los veterinarios están trabajando con “grupos” de ganaderos que participan en el plan, que está financiado en parte por el Programa de Desarrollo Rural. El principal incentivo para los ganaderos es lograr el estado libre de BVD para sus rebaños. En la actualidad, el programa está dirigido por la industria, pero hay planes para redactar leyes para la implementación de un programa obligatorio siguiendo el esquema voluntario.
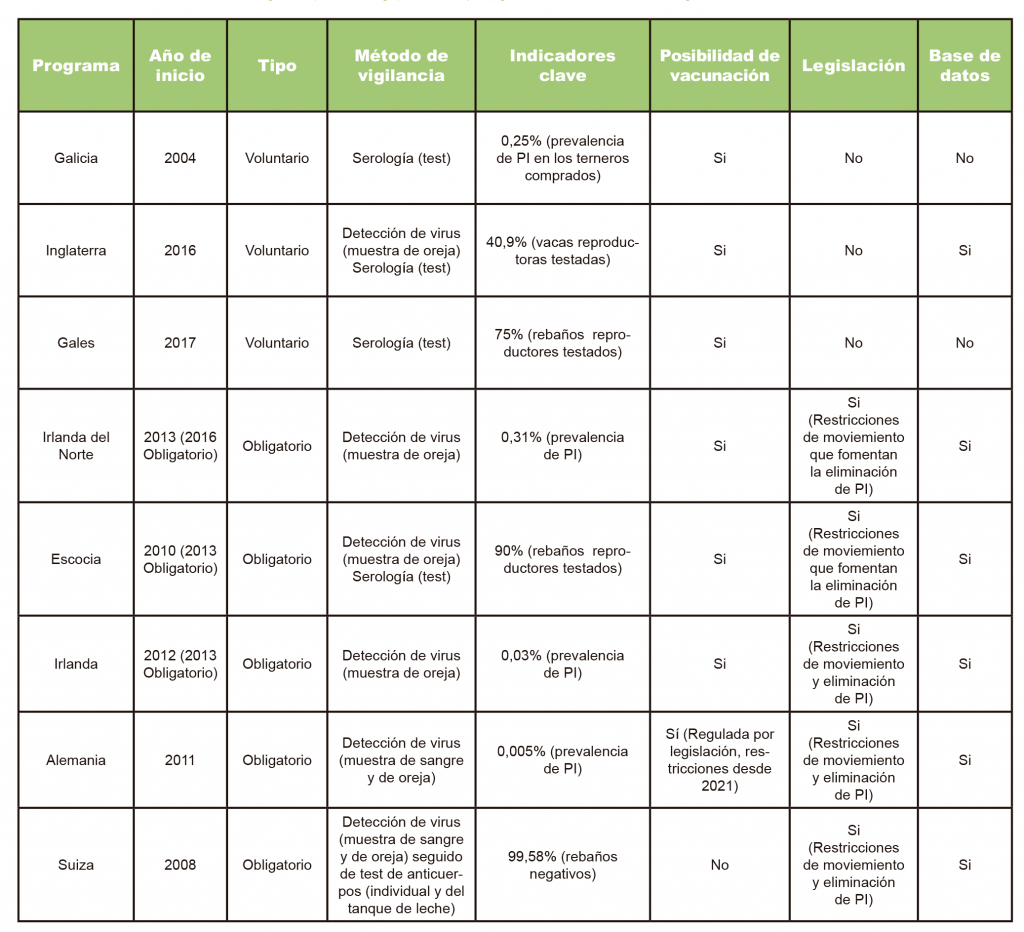
En Gales, las conversaciones entre las partes interesadas comenzaron en 2011 y las pruebas en granjas comenzaron en 2017. En el momento del Congreso, se habían examinado 8.601 granjas. El 75% de los rebaños galeses se sometieron a pruebas de BVD, junto con pruebas de tuberculosis, y 2.446 explotaciones resultaron ser positivas para BVD. Un tercio de las granjas buscaron animales PI y se identificaron 675 animales positivos. La mitad de los PI se quedaron en la granja, el 25% fueron sacrificados y ¡el 25% vendidos! Un grupo directivo formado por las partes interesadas supervisó el programa voluntario. La falta de una base de datos se consideró un problema crítico y, por lo tanto, se intentará vincular el programa con las bases de datos de animales existentes. La planificación con el Gobierno de Gales está progresando para hacer que el control de BVD sea obligatorio y la financiación del programa se ha extendido hasta 2023. Para ver un resumen de los programas actuales de BVD presentados o discutidos en el Congreso BVDzero, consulte la Tabla 1.
 4. Lecciones aprendidas
Desde mediados de la década de 1980, cuando se lanzaron los primeros esfuerzos de control, hasta ahora, el progreso ha sido impresionante en algunos países y excesivamente lento en otros. Hoy en día, la mayor parte de Europa aún no cuenta con programas para el control de la BVD o estos son poco entusiastas. Las graves consecuencias económicas de la infección todavía no son apreciadas en su verdadera magnitud. El retraso en la aparición o incluso la falta de signos clínicos graves es, en parte, responsable de la subestimación de los riesgos relacionados con la BVD y la poca conciencia de los ganaderos sobre este problema. Lo más importante es la falta de evaluación del riesgo real que representa el ganado PI. Los animales PI son una característica única de la patogénesis de BVD. Representan un reservorio muy potente para la infección de animales susceptibles y juegan un papel fundamental en el mantenimiento de la infección en las cabañas ganaderas. Los esfuerzos de control que no identifiquen y eliminen radicalmente a los animales PI están condenados al fracaso. Este requisito es el más complejo. La falta de cumplimiento o las acciones irresponsables son las principales razones por las que fracasan los programas de control. Teniendo en cuenta estos hechos, queda claro que la BVD es más difícil de controlar que una enfermedad infecciosa con signos clínicos claros y manifiestos y sin excreción permanentes del virus. Los aspectos clave de un programa de control de BVD son los siguientes:
• Identificación de rebaños infectados con BVD.
• Identificación y sacrificio de animales PI (test y sacrificio).
• Restricciones de movimiento para el ganado sin un estatus claro.
• Reglas de cuarentena para la entrada de animales.
• Bioseguridad.
• Rastreo completo de infecciones, preferiblemente usando una base de datos.
• Dependiendo de la estrategia de control, la vacunación puede prohibirse o aplicarse como una herramienta de control adicional (inmunización de hembras para prevenir una nueva generación de terneros PI).
• Clasificación de animales y rebaños según su estado BVD.
• Plan financiero sólido y reglas de compensación claras.
• Estrecha comunicación con las partes interesadas.
4. Lecciones aprendidas
Desde mediados de la década de 1980, cuando se lanzaron los primeros esfuerzos de control, hasta ahora, el progreso ha sido impresionante en algunos países y excesivamente lento en otros. Hoy en día, la mayor parte de Europa aún no cuenta con programas para el control de la BVD o estos son poco entusiastas. Las graves consecuencias económicas de la infección todavía no son apreciadas en su verdadera magnitud. El retraso en la aparición o incluso la falta de signos clínicos graves es, en parte, responsable de la subestimación de los riesgos relacionados con la BVD y la poca conciencia de los ganaderos sobre este problema. Lo más importante es la falta de evaluación del riesgo real que representa el ganado PI. Los animales PI son una característica única de la patogénesis de BVD. Representan un reservorio muy potente para la infección de animales susceptibles y juegan un papel fundamental en el mantenimiento de la infección en las cabañas ganaderas. Los esfuerzos de control que no identifiquen y eliminen radicalmente a los animales PI están condenados al fracaso. Este requisito es el más complejo. La falta de cumplimiento o las acciones irresponsables son las principales razones por las que fracasan los programas de control. Teniendo en cuenta estos hechos, queda claro que la BVD es más difícil de controlar que una enfermedad infecciosa con signos clínicos claros y manifiestos y sin excreción permanentes del virus. Los aspectos clave de un programa de control de BVD son los siguientes:
• Identificación de rebaños infectados con BVD.
• Identificación y sacrificio de animales PI (test y sacrificio).
• Restricciones de movimiento para el ganado sin un estatus claro.
• Reglas de cuarentena para la entrada de animales.
• Bioseguridad.
• Rastreo completo de infecciones, preferiblemente usando una base de datos.
• Dependiendo de la estrategia de control, la vacunación puede prohibirse o aplicarse como una herramienta de control adicional (inmunización de hembras para prevenir una nueva generación de terneros PI).
• Clasificación de animales y rebaños según su estado BVD.
• Plan financiero sólido y reglas de compensación claras.
• Estrecha comunicación con las partes interesadas.
 A la luz de estas condiciones, los programas voluntarios son especialmente difíciles de gestionar, porque requieren un alto grado de concienciación, motivación y cumplimiento por parte de las partes interesadas, en particular de los ganaderos participantes. Sin embargo, muchos programas nuevos son el resultado de debates entre las partes interesadas. En lugar de redactar un programa de control sencillo y estricto que haya tenido éxito en otros países, se establecen muchos compromisos por razones aparentemente económicas que ponen en peligro los esfuerzos de control desde el principio. Los ejemplos típicos son regulaciones poco claras o inexistentes con respecto al destino del ganado PI, disposiciones laxas o inexistentes para las restricciones de movimiento y bioseguridad, y la falta de reglas de cuarentena. Tales deficiencias garantizan una larga duración del programa, altos costes y resultados deficientes, e incluso el fracaso. Los programas voluntarios exitosos requerirían una fuerte determinación por parte de todos los interesados. Idealmente, un grupo directivo formado por los actores clave de cada una de las partes interesadas debería facilitar la comunicación con los ganaderos y coordinar las medidas de formación y control. A lo largo del programa, los esfuerzos deben ser medidos y la gestión de datos es importante. En algunos países, las bases de datos de ganado existentes se utilizaron con éxito para apoyar el control de BVD. Los obstáculos son la poca visibilidad del daño causado en muchos rebaños por la BVD endémica, la complejidad del programa, la larga duración y los altos costes de los programas. Los mensajes claros y sencillos, así como la presión de los propios ganaderos, pueden ayudar a mantener la motivación y el entusiasmo de las partes interesadas. El veterinario de la explotación juega un papel importante en este contexto. Dos aspectos particularmente críticos de los enfoques voluntarios son el reto de reclutar al 100% de los ganaderos para que se inscriban y la grave amenaza que representan para los rebaños participantes no vacunados las granjas vecinas infectadas. La mayoría de los programas voluntarios, si no todos, tienen una duración prolongada, son costosos y progresan con relativa lentitud. En consecuencia, en la parte final estos programas, a menudo, se convierten en programas obligatorios impulsados por el gobierno.
Por el contrario, los programas obligatorios de control sistemático de la BVD impulsados por la legislación hasta ahora han sido muy eficaces, como se ha demostrado en varios países europeos. Como ocurre con todos los programas, los planes obligatorios también requieren una comunicación profesional y un alto nivel de concienciación y motivación por parte de todas las partes interesadas. Su principal ventaja es que todos los ganaderos están obligados a participar. Sin embargo, al igual que con los enfoques voluntarios, también necesita un apoyo total de las partes interesadas, y la falta de cumplimiento puede causar serios contratiempos y retrasos.
Además de la complejidad del proceso de control, la falta de incentivos comerciales en el pasado también es culpable del lento progreso en Europa. Durante mucho tiempo en los esfuerzos de control de la BVD, no hubo regulaciones comerciales internacionales vigentes con respecto a BVD. El Código Terrestre de la OIE todavía no tiene un capítulo sobre el control de la BVD y las normas comerciales correspondientes y, en la UE, las únicas normas relacionadas con la BVD se limitaban a los gametos. Esto ha cambiado con la introducción de la Ley europea de sanidad animal[20]. Por primera vez, la BVD se incluye como una enfermedad de categoría C para el control opcional y en el Reglamento Delegado de la Comisión[21] se establecen disposiciones sobre los programas de control y la concesión y el mantenimiento del estatus de libre de enfermedad. Estas son similares a las reglas “antiguas” para las enfermedades de la lista, por ejemplo, la leucosis bovina, con respecto a los artículos 9 y 10[22]. Con respecto al diagnóstico de laboratorio de la BVD, la legislación actual de la UE se refiere al “Manual de Pruebas de Diagnóstico y Vacunas para los Animales Terrestres de la OIE”[23]. El control de BVD en los Estados miembros o zonas se describe detalladamente en la Parte VI del Reglamento (UE) 2020/689[21]. La Comisión podrá autorizar programas de control de BVD para Estados miembros o zonas y otorgará el estatus de libre de BVD. Las autoridades competentes podrán otorgar o retirar el estatus de libre de BVD a las explotaciones ganaderas. Con respecto al comercio con ganado, el proveedor debe otorgar garantías adicionales según el estado de destino. Sin embargo, dado que existe cierta heterogeneidad en el diseño de los programas de control, se debe comprobar la probabilidad de ausencia de infección para asegurar el comercio[24]. En los Estados miembros o zonas libres de BVD, la vacunación está prohibida.
5. Conclusiones
Durante las últimas tres décadas, ha surgido un camino claro hacia el control exitoso de BVD. Siempre que haya voluntad política, un fuerte apoyo de las partes interesadas y la aplicación de métodos probados, el control de esta enfermedad económicamente importante ya no debería ser un problema. Con el nuevo marco legislativo, cabe esperar que el control de la BVD en Europa cobre impulso en los próximos años.
Referencias
1. Olafson, P.; Maccallum, A.D.; Fox, F.H. An apparently new transmissible disease of cattle. Cornell Vet. 1946, 36, 205–213.
2. Rebhun, W.C.; French, T.W.; Perdrizet, J.A.; Dubovi, E.J.; Dill, S.G.; Karcher, L.F. Thrombocytopenia Associated With Acute Bovine Virus Diarrhea Infection in Cattle. J. Vet. Intern. Med. 1989, 3, 42–46.
3. Bolin, S.R.; McClurkin, A.W.; Cutlip, R.C.; Coria, M.F. Severe clinical disease induced in cattle persistently infected with
noncyto-pathic bovine viral diarrhea virus by superinfection with cytopathic bovine viral diarrhea virus. AMJ Vet. Res. 1985, 46, 573–576.
4. Brownlie, J.; Clarke, M.C.; Howard, C.J. Experimental production of fatal mucosal disease in cattle. Vet. Rec. 1984, 114,
535–536.
5. Niskanen, R.; Emanuelson, U.; Sundberg, J.; Larssond, B.; Alenius, S. Effects of infection with bovine virus diarrhoea virus on health and reproductive performance in 2 13 dairy herds in one county in Sweden. Prev. Vet. Med. 1995, 23, 229–237.
6. Richter, V.; Bakran-Lebl, K.; Baumgartner, W.; Obritzhauser, W.; Käsbohrer, A.; Pinior, B. A systematic worldwide review of the direct monetary losses in cattle due to bovine viral diarrhoea virus infection. Vet. J. 2017, 220, 80–87.
7. Yarnall, M.J.; Thrusfield, M.V. Engaging veterinarians and farmers in eradicating bovine viral diarrhoea: A systematic review of economic impact. Vet. Rec. 2017, 181, 347
8. Gottschalk, E.E.; Greiser-Wilke, I.; Liess, B.; Moennig, V.; Frey, H.-R. An Antigen Capture Test for the Detection of Cattle Viremic with Bovine Viral Diarrhoea Virus—A Comparison with BVD Virus Isolation from Buffy Coat Cells in Bovine Kidney Cells. J. Veter Med. Ser. B 1992, 39, 467–472.
9. Flebbe, U.; Mehrkens, L. BVD/MD and its control in Lower Saxony (after the support of the Lower Saxony animal epidemic fund). DTW. Dtsch. Tierarztl. Wochenschr. 1992, 99, 217–220.
10. Houe, H.; Lindberg, A.; Moennig, V. Test strategies in bovine viral diarrhea virus control and eradication campaigns in Europe. J. Vet. Diagn. Investig. 2006, 18, 427–436.
11. Valle, P.S.; Skjerve, E.; Martin, S.W.; Larssen, R.B.; Osteras, O.; Nyberg, O. Ten years of bovine virus diarrhoea virus (BVDV) con-trol in Norway: A cost-benefit analysis. Prev. Vet. Med. 2005, 72, 189–207.
12. Marschik, T.; Obritzhauser, W.; Wagner, P.; Richter, V.; Mayerhofer, M.; Egger-Danner, C.; Käsbohrer, A.; Pinior, B. A cost-benefit analysis and the potential trade effects of the bovine viral diarrhoea eradication programme in Styria, Austria. Vet. J. 2018, 231, 19–29.
13. Evans, C.A.; Pinior, B.; Larska, M.; Graham, D.; Schweizer, M.; Guidarini, C.; DeCaro, N.; Ridpath, J.; Gates, M.C. Global knowledge gaps in the prevention and control of bovine viral diarrhoea (BVD) virus. Transbound. Emerg. Dis. 2019, 66, 640–652.
14. Stalder, H.; Hug, C.; Zanoni, R.; Vogt, H.R.; Peterhans, E.; Schweizer, M.; Bachofen, C. A nationwide database linking information on the hosts with sequence data of their virus strains: A useful tool for the eradication of bovine viral diarrhea (BVD) in Switzer-land. Virus Res. 2016, 218, 49–56.
15. Kaiser, V.; Nebel, L.; Schüpbach-Regula, G.; Zanoni, R.G.; Schweizer, M. Influence of border disease virus (BDV) on serological surveillance within the bovine virus diarrhea (BVD) eradication program in Switzerland. BMC Vet. Res. 2016, 13, 1–13.
16. Casaubon, J.; Vogt, H.-R.; Stalder, H.; Hug, C.; Ryser-Degiorgis, M.-P. Bovine viral diarrhea virus in free-ranging wild ruminants in Switzerland: Low prevalence of infection despite regular interactions with domestic livestock. BMC Vet. Res. 2012, 8, 204.
17. Frölich, K.; Thiede, S.; Kozikowski, T.; Jakob, W. A Review of Mutual Transmission of Important Infectious Diseases between Livestock and Wildlife in Europe. Ann. N. Y. Acad. Sci. 2002, 969, 4–13.
18. Schweizer, M.; Stalder, H.; Haslebacher, A.; Grisiger, M.; Schwermer, H.; Di Labio, E. Eradication of Bovine Viral Diarrhoea (BVD) in Cattle in Switzerland: Lessons Taught by the Complex Biology of the Virus. Front. Vet. Sci. 2021, 8, 1012.
19. Wernike, K.; Gethmann, J.; Schirrmeier, H.; Schröder, R.; Conraths, F.J.; Beer, M. Six Years (2011–2016) of Mandatory Nationwide Bovine Viral Diarrhea Control in Germany—A Success Story. Pathogens 2017, 6, 50.
15. Kaiser, V.; Nebel, L.; Schüpbach-Regula, G.; Zanoni, R.G.; Schweizer, M. Influence of border disease virus (BDV) on serological surveillance within the bovine virus diarrhea (BVD) eradication program in Switzerland. BMC Vet. Res. 2016, 13, 1–13.
16. Casaubon, J.; Vogt, H.-R.; Stalder, H.; Hug, C.; Ryser-Degiorgis, M.-P. Bovine viral diarrhea virus in free-ranging wild ruminants in Switzerland: Low prevalence of infection despite regular interactions with domestic livestock. BMC Vet. Res. 2012, 8, 204.
17. Frölich, K.; Thiede, S.; Kozikowski, T.; Jakob, W. A Review of Mutual Transmission of Important Infectious Diseases between Livestock and Wildlife in Europe. Ann. N. Y. Acad. Sci. 2002, 969, 4–13.
18. Schweizer, M.; Stalder, H.; Haslebacher, A.; Grisiger, M.; Schwermer, H.; Di Labio, E. Eradication of Bovine Viral Diarrhoea (BVD) in Cattle in Switzerland: Lessons Taught by the Complex Biology of the Virus. Front. Vet. Sci. 2021, 8, 1012.
19. Wernike, K.; Gethmann, J.; Schirrmeier, H.; Schröder, R.; Conraths, F.J.; Beer, M. Six Years (2011–2016) of Mandatory Nationwide Bovine Viral Diarrhea Control in Germany—A Success Story. Pathogens 2017, 6, 50.
20. Anonymous. (EU) 2016/429 EU Animal Health Law. Off. J. Eur. Union 2016, L84, 1–208.
21. Anonymous. (EU) 2020/689 Supplement EU Animal Health Law. Off. J. Eur. Union 2019, L174, 211–340.
22. Anonymous. (64/432/EEC) COUNCIL DIRECTIVE of 26 June 1964 on animal health problems affecting intra-Community trade in bovine animals and swine. Off. J. Eur. Communities 1964, 64, 164–184.
23. Kirkland, P. Bovine Viral Diarrhoea; OIE Terrestrial Manual; Office International des Épizooties: Paris, France, 2018.
24. Van Roon, A.M.; Santman-Berends, I.; Graham, D.; More, S.J.; Nielen, M.; Madouasse, A.; Mercat, M.; Fourichon, C.; Gethmann, J.; Frössling, J.; et al. STOC Free: An Innovative Framework to Compare Probability of Freedom From Infection in Heterogeneous Control Programmes. Front. Vet. Sci. 2019, 6, 133.
Este artículo es un resumen y adaptación del trabajo original publicado, bajo el título de “The Long Journey to BVD Eradication”, en la revista Pathogens 2021, 10, 1292. https://doi.org/10.3390/pathogens10101292
A la luz de estas condiciones, los programas voluntarios son especialmente difíciles de gestionar, porque requieren un alto grado de concienciación, motivación y cumplimiento por parte de las partes interesadas, en particular de los ganaderos participantes. Sin embargo, muchos programas nuevos son el resultado de debates entre las partes interesadas. En lugar de redactar un programa de control sencillo y estricto que haya tenido éxito en otros países, se establecen muchos compromisos por razones aparentemente económicas que ponen en peligro los esfuerzos de control desde el principio. Los ejemplos típicos son regulaciones poco claras o inexistentes con respecto al destino del ganado PI, disposiciones laxas o inexistentes para las restricciones de movimiento y bioseguridad, y la falta de reglas de cuarentena. Tales deficiencias garantizan una larga duración del programa, altos costes y resultados deficientes, e incluso el fracaso. Los programas voluntarios exitosos requerirían una fuerte determinación por parte de todos los interesados. Idealmente, un grupo directivo formado por los actores clave de cada una de las partes interesadas debería facilitar la comunicación con los ganaderos y coordinar las medidas de formación y control. A lo largo del programa, los esfuerzos deben ser medidos y la gestión de datos es importante. En algunos países, las bases de datos de ganado existentes se utilizaron con éxito para apoyar el control de BVD. Los obstáculos son la poca visibilidad del daño causado en muchos rebaños por la BVD endémica, la complejidad del programa, la larga duración y los altos costes de los programas. Los mensajes claros y sencillos, así como la presión de los propios ganaderos, pueden ayudar a mantener la motivación y el entusiasmo de las partes interesadas. El veterinario de la explotación juega un papel importante en este contexto. Dos aspectos particularmente críticos de los enfoques voluntarios son el reto de reclutar al 100% de los ganaderos para que se inscriban y la grave amenaza que representan para los rebaños participantes no vacunados las granjas vecinas infectadas. La mayoría de los programas voluntarios, si no todos, tienen una duración prolongada, son costosos y progresan con relativa lentitud. En consecuencia, en la parte final estos programas, a menudo, se convierten en programas obligatorios impulsados por el gobierno.
Por el contrario, los programas obligatorios de control sistemático de la BVD impulsados por la legislación hasta ahora han sido muy eficaces, como se ha demostrado en varios países europeos. Como ocurre con todos los programas, los planes obligatorios también requieren una comunicación profesional y un alto nivel de concienciación y motivación por parte de todas las partes interesadas. Su principal ventaja es que todos los ganaderos están obligados a participar. Sin embargo, al igual que con los enfoques voluntarios, también necesita un apoyo total de las partes interesadas, y la falta de cumplimiento puede causar serios contratiempos y retrasos.
Además de la complejidad del proceso de control, la falta de incentivos comerciales en el pasado también es culpable del lento progreso en Europa. Durante mucho tiempo en los esfuerzos de control de la BVD, no hubo regulaciones comerciales internacionales vigentes con respecto a BVD. El Código Terrestre de la OIE todavía no tiene un capítulo sobre el control de la BVD y las normas comerciales correspondientes y, en la UE, las únicas normas relacionadas con la BVD se limitaban a los gametos. Esto ha cambiado con la introducción de la Ley europea de sanidad animal[20]. Por primera vez, la BVD se incluye como una enfermedad de categoría C para el control opcional y en el Reglamento Delegado de la Comisión[21] se establecen disposiciones sobre los programas de control y la concesión y el mantenimiento del estatus de libre de enfermedad. Estas son similares a las reglas “antiguas” para las enfermedades de la lista, por ejemplo, la leucosis bovina, con respecto a los artículos 9 y 10[22]. Con respecto al diagnóstico de laboratorio de la BVD, la legislación actual de la UE se refiere al “Manual de Pruebas de Diagnóstico y Vacunas para los Animales Terrestres de la OIE”[23]. El control de BVD en los Estados miembros o zonas se describe detalladamente en la Parte VI del Reglamento (UE) 2020/689[21]. La Comisión podrá autorizar programas de control de BVD para Estados miembros o zonas y otorgará el estatus de libre de BVD. Las autoridades competentes podrán otorgar o retirar el estatus de libre de BVD a las explotaciones ganaderas. Con respecto al comercio con ganado, el proveedor debe otorgar garantías adicionales según el estado de destino. Sin embargo, dado que existe cierta heterogeneidad en el diseño de los programas de control, se debe comprobar la probabilidad de ausencia de infección para asegurar el comercio[24]. En los Estados miembros o zonas libres de BVD, la vacunación está prohibida.
5. Conclusiones
Durante las últimas tres décadas, ha surgido un camino claro hacia el control exitoso de BVD. Siempre que haya voluntad política, un fuerte apoyo de las partes interesadas y la aplicación de métodos probados, el control de esta enfermedad económicamente importante ya no debería ser un problema. Con el nuevo marco legislativo, cabe esperar que el control de la BVD en Europa cobre impulso en los próximos años.
Referencias
1. Olafson, P.; Maccallum, A.D.; Fox, F.H. An apparently new transmissible disease of cattle. Cornell Vet. 1946, 36, 205–213.
2. Rebhun, W.C.; French, T.W.; Perdrizet, J.A.; Dubovi, E.J.; Dill, S.G.; Karcher, L.F. Thrombocytopenia Associated With Acute Bovine Virus Diarrhea Infection in Cattle. J. Vet. Intern. Med. 1989, 3, 42–46.
3. Bolin, S.R.; McClurkin, A.W.; Cutlip, R.C.; Coria, M.F. Severe clinical disease induced in cattle persistently infected with
noncyto-pathic bovine viral diarrhea virus by superinfection with cytopathic bovine viral diarrhea virus. AMJ Vet. Res. 1985, 46, 573–576.
4. Brownlie, J.; Clarke, M.C.; Howard, C.J. Experimental production of fatal mucosal disease in cattle. Vet. Rec. 1984, 114,
535–536.
5. Niskanen, R.; Emanuelson, U.; Sundberg, J.; Larssond, B.; Alenius, S. Effects of infection with bovine virus diarrhoea virus on health and reproductive performance in 2 13 dairy herds in one county in Sweden. Prev. Vet. Med. 1995, 23, 229–237.
6. Richter, V.; Bakran-Lebl, K.; Baumgartner, W.; Obritzhauser, W.; Käsbohrer, A.; Pinior, B. A systematic worldwide review of the direct monetary losses in cattle due to bovine viral diarrhoea virus infection. Vet. J. 2017, 220, 80–87.
7. Yarnall, M.J.; Thrusfield, M.V. Engaging veterinarians and farmers in eradicating bovine viral diarrhoea: A systematic review of economic impact. Vet. Rec. 2017, 181, 347
8. Gottschalk, E.E.; Greiser-Wilke, I.; Liess, B.; Moennig, V.; Frey, H.-R. An Antigen Capture Test for the Detection of Cattle Viremic with Bovine Viral Diarrhoea Virus—A Comparison with BVD Virus Isolation from Buffy Coat Cells in Bovine Kidney Cells. J. Veter Med. Ser. B 1992, 39, 467–472.
9. Flebbe, U.; Mehrkens, L. BVD/MD and its control in Lower Saxony (after the support of the Lower Saxony animal epidemic fund). DTW. Dtsch. Tierarztl. Wochenschr. 1992, 99, 217–220.
10. Houe, H.; Lindberg, A.; Moennig, V. Test strategies in bovine viral diarrhea virus control and eradication campaigns in Europe. J. Vet. Diagn. Investig. 2006, 18, 427–436.
11. Valle, P.S.; Skjerve, E.; Martin, S.W.; Larssen, R.B.; Osteras, O.; Nyberg, O. Ten years of bovine virus diarrhoea virus (BVDV) con-trol in Norway: A cost-benefit analysis. Prev. Vet. Med. 2005, 72, 189–207.
12. Marschik, T.; Obritzhauser, W.; Wagner, P.; Richter, V.; Mayerhofer, M.; Egger-Danner, C.; Käsbohrer, A.; Pinior, B. A cost-benefit analysis and the potential trade effects of the bovine viral diarrhoea eradication programme in Styria, Austria. Vet. J. 2018, 231, 19–29.
13. Evans, C.A.; Pinior, B.; Larska, M.; Graham, D.; Schweizer, M.; Guidarini, C.; DeCaro, N.; Ridpath, J.; Gates, M.C. Global knowledge gaps in the prevention and control of bovine viral diarrhoea (BVD) virus. Transbound. Emerg. Dis. 2019, 66, 640–652.
14. Stalder, H.; Hug, C.; Zanoni, R.; Vogt, H.R.; Peterhans, E.; Schweizer, M.; Bachofen, C. A nationwide database linking information on the hosts with sequence data of their virus strains: A useful tool for the eradication of bovine viral diarrhea (BVD) in Switzer-land. Virus Res. 2016, 218, 49–56.
15. Kaiser, V.; Nebel, L.; Schüpbach-Regula, G.; Zanoni, R.G.; Schweizer, M. Influence of border disease virus (BDV) on serological surveillance within the bovine virus diarrhea (BVD) eradication program in Switzerland. BMC Vet. Res. 2016, 13, 1–13.
16. Casaubon, J.; Vogt, H.-R.; Stalder, H.; Hug, C.; Ryser-Degiorgis, M.-P. Bovine viral diarrhea virus in free-ranging wild ruminants in Switzerland: Low prevalence of infection despite regular interactions with domestic livestock. BMC Vet. Res. 2012, 8, 204.
17. Frölich, K.; Thiede, S.; Kozikowski, T.; Jakob, W. A Review of Mutual Transmission of Important Infectious Diseases between Livestock and Wildlife in Europe. Ann. N. Y. Acad. Sci. 2002, 969, 4–13.
18. Schweizer, M.; Stalder, H.; Haslebacher, A.; Grisiger, M.; Schwermer, H.; Di Labio, E. Eradication of Bovine Viral Diarrhoea (BVD) in Cattle in Switzerland: Lessons Taught by the Complex Biology of the Virus. Front. Vet. Sci. 2021, 8, 1012.
19. Wernike, K.; Gethmann, J.; Schirrmeier, H.; Schröder, R.; Conraths, F.J.; Beer, M. Six Years (2011–2016) of Mandatory Nationwide Bovine Viral Diarrhea Control in Germany—A Success Story. Pathogens 2017, 6, 50.
15. Kaiser, V.; Nebel, L.; Schüpbach-Regula, G.; Zanoni, R.G.; Schweizer, M. Influence of border disease virus (BDV) on serological surveillance within the bovine virus diarrhea (BVD) eradication program in Switzerland. BMC Vet. Res. 2016, 13, 1–13.
16. Casaubon, J.; Vogt, H.-R.; Stalder, H.; Hug, C.; Ryser-Degiorgis, M.-P. Bovine viral diarrhea virus in free-ranging wild ruminants in Switzerland: Low prevalence of infection despite regular interactions with domestic livestock. BMC Vet. Res. 2012, 8, 204.
17. Frölich, K.; Thiede, S.; Kozikowski, T.; Jakob, W. A Review of Mutual Transmission of Important Infectious Diseases between Livestock and Wildlife in Europe. Ann. N. Y. Acad. Sci. 2002, 969, 4–13.
18. Schweizer, M.; Stalder, H.; Haslebacher, A.; Grisiger, M.; Schwermer, H.; Di Labio, E. Eradication of Bovine Viral Diarrhoea (BVD) in Cattle in Switzerland: Lessons Taught by the Complex Biology of the Virus. Front. Vet. Sci. 2021, 8, 1012.
19. Wernike, K.; Gethmann, J.; Schirrmeier, H.; Schröder, R.; Conraths, F.J.; Beer, M. Six Years (2011–2016) of Mandatory Nationwide Bovine Viral Diarrhea Control in Germany—A Success Story. Pathogens 2017, 6, 50.
20. Anonymous. (EU) 2016/429 EU Animal Health Law. Off. J. Eur. Union 2016, L84, 1–208.
21. Anonymous. (EU) 2020/689 Supplement EU Animal Health Law. Off. J. Eur. Union 2019, L174, 211–340.
22. Anonymous. (64/432/EEC) COUNCIL DIRECTIVE of 26 June 1964 on animal health problems affecting intra-Community trade in bovine animals and swine. Off. J. Eur. Communities 1964, 64, 164–184.
23. Kirkland, P. Bovine Viral Diarrhoea; OIE Terrestrial Manual; Office International des Épizooties: Paris, France, 2018.
24. Van Roon, A.M.; Santman-Berends, I.; Graham, D.; More, S.J.; Nielen, M.; Madouasse, A.; Mercat, M.; Fourichon, C.; Gethmann, J.; Frössling, J.; et al. STOC Free: An Innovative Framework to Compare Probability of Freedom From Infection in Heterogeneous Control Programmes. Front. Vet. Sci. 2019, 6, 133.
Este artículo es un resumen y adaptación del trabajo original publicado, bajo el título de “The Long Journey to BVD Eradication”, en la revista Pathogens 2021, 10, 1292. https://doi.org/10.3390/pathogens10101292

Tabla 1. Un resumen de los programas actuales de erradicación de BVD presentados o discutidos en el Congreso BVDzero 2021.
 A la luz de estas condiciones, los programas voluntarios son especialmente difíciles de gestionar, porque requieren un alto grado de concienciación, motivación y cumplimiento por parte de las partes interesadas, en particular de los ganaderos participantes. Sin embargo, muchos programas nuevos son el resultado de debates entre las partes interesadas. En lugar de redactar un programa de control sencillo y estricto que haya tenido éxito en otros países, se establecen muchos compromisos por razones aparentemente económicas que ponen en peligro los esfuerzos de control desde el principio. Los ejemplos típicos son regulaciones poco claras o inexistentes con respecto al destino del ganado PI, disposiciones laxas o inexistentes para las restricciones de movimiento y bioseguridad, y la falta de reglas de cuarentena. Tales deficiencias garantizan una larga duración del programa, altos costes y resultados deficientes, e incluso el fracaso. Los programas voluntarios exitosos requerirían una fuerte determinación por parte de todos los interesados. Idealmente, un grupo directivo formado por los actores clave de cada una de las partes interesadas debería facilitar la comunicación con los ganaderos y coordinar las medidas de formación y control. A lo largo del programa, los esfuerzos deben ser medidos y la gestión de datos es importante. En algunos países, las bases de datos de ganado existentes se utilizaron con éxito para apoyar el control de BVD. Los obstáculos son la poca visibilidad del daño causado en muchos rebaños por la BVD endémica, la complejidad del programa, la larga duración y los altos costes de los programas. Los mensajes claros y sencillos, así como la presión de los propios ganaderos, pueden ayudar a mantener la motivación y el entusiasmo de las partes interesadas. El veterinario de la explotación juega un papel importante en este contexto. Dos aspectos particularmente críticos de los enfoques voluntarios son el reto de reclutar al 100% de los ganaderos para que se inscriban y la grave amenaza que representan para los rebaños participantes no vacunados las granjas vecinas infectadas. La mayoría de los programas voluntarios, si no todos, tienen una duración prolongada, son costosos y progresan con relativa lentitud. En consecuencia, en la parte final estos programas, a menudo, se convierten en programas obligatorios impulsados por el gobierno.
Por el contrario, los programas obligatorios de control sistemático de la BVD impulsados por la legislación hasta ahora han sido muy eficaces, como se ha demostrado en varios países europeos. Como ocurre con todos los programas, los planes obligatorios también requieren una comunicación profesional y un alto nivel de concienciación y motivación por parte de todas las partes interesadas. Su principal ventaja es que todos los ganaderos están obligados a participar. Sin embargo, al igual que con los enfoques voluntarios, también necesita un apoyo total de las partes interesadas, y la falta de cumplimiento puede causar serios contratiempos y retrasos.
Además de la complejidad del proceso de control, la falta de incentivos comerciales en el pasado también es culpable del lento progreso en Europa. Durante mucho tiempo en los esfuerzos de control de la BVD, no hubo regulaciones comerciales internacionales vigentes con respecto a BVD. El Código Terrestre de la OIE todavía no tiene un capítulo sobre el control de la BVD y las normas comerciales correspondientes y, en la UE, las únicas normas relacionadas con la BVD se limitaban a los gametos. Esto ha cambiado con la introducción de la Ley europea de sanidad animal[20]. Por primera vez, la BVD se incluye como una enfermedad de categoría C para el control opcional y en el Reglamento Delegado de la Comisión[21] se establecen disposiciones sobre los programas de control y la concesión y el mantenimiento del estatus de libre de enfermedad. Estas son similares a las reglas “antiguas” para las enfermedades de la lista, por ejemplo, la leucosis bovina, con respecto a los artículos 9 y 10[22]. Con respecto al diagnóstico de laboratorio de la BVD, la legislación actual de la UE se refiere al “Manual de Pruebas de Diagnóstico y Vacunas para los Animales Terrestres de la OIE”[23]. El control de BVD en los Estados miembros o zonas se describe detalladamente en la Parte VI del Reglamento (UE) 2020/689[21]. La Comisión podrá autorizar programas de control de BVD para Estados miembros o zonas y otorgará el estatus de libre de BVD. Las autoridades competentes podrán otorgar o retirar el estatus de libre de BVD a las explotaciones ganaderas. Con respecto al comercio con ganado, el proveedor debe otorgar garantías adicionales según el estado de destino. Sin embargo, dado que existe cierta heterogeneidad en el diseño de los programas de control, se debe comprobar la probabilidad de ausencia de infección para asegurar el comercio[24]. En los Estados miembros o zonas libres de BVD, la vacunación está prohibida.
5. Conclusiones
Durante las últimas tres décadas, ha surgido un camino claro hacia el control exitoso de BVD. Siempre que haya voluntad política, un fuerte apoyo de las partes interesadas y la aplicación de métodos probados, el control de esta enfermedad económicamente importante ya no debería ser un problema. Con el nuevo marco legislativo, cabe esperar que el control de la BVD en Europa cobre impulso en los próximos años.
Referencias
1. Olafson, P.; Maccallum, A.D.; Fox, F.H. An apparently new transmissible disease of cattle. Cornell Vet. 1946, 36, 205–213.
2. Rebhun, W.C.; French, T.W.; Perdrizet, J.A.; Dubovi, E.J.; Dill, S.G.; Karcher, L.F. Thrombocytopenia Associated With Acute Bovine Virus Diarrhea Infection in Cattle. J. Vet. Intern. Med. 1989, 3, 42–46.
3. Bolin, S.R.; McClurkin, A.W.; Cutlip, R.C.; Coria, M.F. Severe clinical disease induced in cattle persistently infected with
noncyto-pathic bovine viral diarrhea virus by superinfection with cytopathic bovine viral diarrhea virus. AMJ Vet. Res. 1985, 46, 573–576.
4. Brownlie, J.; Clarke, M.C.; Howard, C.J. Experimental production of fatal mucosal disease in cattle. Vet. Rec. 1984, 114,
535–536.
5. Niskanen, R.; Emanuelson, U.; Sundberg, J.; Larssond, B.; Alenius, S. Effects of infection with bovine virus diarrhoea virus on health and reproductive performance in 2 13 dairy herds in one county in Sweden. Prev. Vet. Med. 1995, 23, 229–237.
6. Richter, V.; Bakran-Lebl, K.; Baumgartner, W.; Obritzhauser, W.; Käsbohrer, A.; Pinior, B. A systematic worldwide review of the direct monetary losses in cattle due to bovine viral diarrhoea virus infection. Vet. J. 2017, 220, 80–87.
7. Yarnall, M.J.; Thrusfield, M.V. Engaging veterinarians and farmers in eradicating bovine viral diarrhoea: A systematic review of economic impact. Vet. Rec. 2017, 181, 347
8. Gottschalk, E.E.; Greiser-Wilke, I.; Liess, B.; Moennig, V.; Frey, H.-R. An Antigen Capture Test for the Detection of Cattle Viremic with Bovine Viral Diarrhoea Virus—A Comparison with BVD Virus Isolation from Buffy Coat Cells in Bovine Kidney Cells. J. Veter Med. Ser. B 1992, 39, 467–472.
9. Flebbe, U.; Mehrkens, L. BVD/MD and its control in Lower Saxony (after the support of the Lower Saxony animal epidemic fund). DTW. Dtsch. Tierarztl. Wochenschr. 1992, 99, 217–220.
10. Houe, H.; Lindberg, A.; Moennig, V. Test strategies in bovine viral diarrhea virus control and eradication campaigns in Europe. J. Vet. Diagn. Investig. 2006, 18, 427–436.
11. Valle, P.S.; Skjerve, E.; Martin, S.W.; Larssen, R.B.; Osteras, O.; Nyberg, O. Ten years of bovine virus diarrhoea virus (BVDV) con-trol in Norway: A cost-benefit analysis. Prev. Vet. Med. 2005, 72, 189–207.
12. Marschik, T.; Obritzhauser, W.; Wagner, P.; Richter, V.; Mayerhofer, M.; Egger-Danner, C.; Käsbohrer, A.; Pinior, B. A cost-benefit analysis and the potential trade effects of the bovine viral diarrhoea eradication programme in Styria, Austria. Vet. J. 2018, 231, 19–29.
13. Evans, C.A.; Pinior, B.; Larska, M.; Graham, D.; Schweizer, M.; Guidarini, C.; DeCaro, N.; Ridpath, J.; Gates, M.C. Global knowledge gaps in the prevention and control of bovine viral diarrhoea (BVD) virus. Transbound. Emerg. Dis. 2019, 66, 640–652.
14. Stalder, H.; Hug, C.; Zanoni, R.; Vogt, H.R.; Peterhans, E.; Schweizer, M.; Bachofen, C. A nationwide database linking information on the hosts with sequence data of their virus strains: A useful tool for the eradication of bovine viral diarrhea (BVD) in Switzer-land. Virus Res. 2016, 218, 49–56.
15. Kaiser, V.; Nebel, L.; Schüpbach-Regula, G.; Zanoni, R.G.; Schweizer, M. Influence of border disease virus (BDV) on serological surveillance within the bovine virus diarrhea (BVD) eradication program in Switzerland. BMC Vet. Res. 2016, 13, 1–13.
16. Casaubon, J.; Vogt, H.-R.; Stalder, H.; Hug, C.; Ryser-Degiorgis, M.-P. Bovine viral diarrhea virus in free-ranging wild ruminants in Switzerland: Low prevalence of infection despite regular interactions with domestic livestock. BMC Vet. Res. 2012, 8, 204.
17. Frölich, K.; Thiede, S.; Kozikowski, T.; Jakob, W. A Review of Mutual Transmission of Important Infectious Diseases between Livestock and Wildlife in Europe. Ann. N. Y. Acad. Sci. 2002, 969, 4–13.
18. Schweizer, M.; Stalder, H.; Haslebacher, A.; Grisiger, M.; Schwermer, H.; Di Labio, E. Eradication of Bovine Viral Diarrhoea (BVD) in Cattle in Switzerland: Lessons Taught by the Complex Biology of the Virus. Front. Vet. Sci. 2021, 8, 1012.
19. Wernike, K.; Gethmann, J.; Schirrmeier, H.; Schröder, R.; Conraths, F.J.; Beer, M. Six Years (2011–2016) of Mandatory Nationwide Bovine Viral Diarrhea Control in Germany—A Success Story. Pathogens 2017, 6, 50.
15. Kaiser, V.; Nebel, L.; Schüpbach-Regula, G.; Zanoni, R.G.; Schweizer, M. Influence of border disease virus (BDV) on serological surveillance within the bovine virus diarrhea (BVD) eradication program in Switzerland. BMC Vet. Res. 2016, 13, 1–13.
16. Casaubon, J.; Vogt, H.-R.; Stalder, H.; Hug, C.; Ryser-Degiorgis, M.-P. Bovine viral diarrhea virus in free-ranging wild ruminants in Switzerland: Low prevalence of infection despite regular interactions with domestic livestock. BMC Vet. Res. 2012, 8, 204.
17. Frölich, K.; Thiede, S.; Kozikowski, T.; Jakob, W. A Review of Mutual Transmission of Important Infectious Diseases between Livestock and Wildlife in Europe. Ann. N. Y. Acad. Sci. 2002, 969, 4–13.
18. Schweizer, M.; Stalder, H.; Haslebacher, A.; Grisiger, M.; Schwermer, H.; Di Labio, E. Eradication of Bovine Viral Diarrhoea (BVD) in Cattle in Switzerland: Lessons Taught by the Complex Biology of the Virus. Front. Vet. Sci. 2021, 8, 1012.
19. Wernike, K.; Gethmann, J.; Schirrmeier, H.; Schröder, R.; Conraths, F.J.; Beer, M. Six Years (2011–2016) of Mandatory Nationwide Bovine Viral Diarrhea Control in Germany—A Success Story. Pathogens 2017, 6, 50.
20. Anonymous. (EU) 2016/429 EU Animal Health Law. Off. J. Eur. Union 2016, L84, 1–208.
21. Anonymous. (EU) 2020/689 Supplement EU Animal Health Law. Off. J. Eur. Union 2019, L174, 211–340.
22. Anonymous. (64/432/EEC) COUNCIL DIRECTIVE of 26 June 1964 on animal health problems affecting intra-Community trade in bovine animals and swine. Off. J. Eur. Communities 1964, 64, 164–184.
23. Kirkland, P. Bovine Viral Diarrhoea; OIE Terrestrial Manual; Office International des Épizooties: Paris, France, 2018.
24. Van Roon, A.M.; Santman-Berends, I.; Graham, D.; More, S.J.; Nielen, M.; Madouasse, A.; Mercat, M.; Fourichon, C.; Gethmann, J.; Frössling, J.; et al. STOC Free: An Innovative Framework to Compare Probability of Freedom From Infection in Heterogeneous Control Programmes. Front. Vet. Sci. 2019, 6, 133.
Este artículo es un resumen y adaptación del trabajo original publicado, bajo el título de “The Long Journey to BVD Eradication”, en la revista Pathogens 2021, 10, 1292. https://doi.org/10.3390/pathogens10101292
A la luz de estas condiciones, los programas voluntarios son especialmente difíciles de gestionar, porque requieren un alto grado de concienciación, motivación y cumplimiento por parte de las partes interesadas, en particular de los ganaderos participantes. Sin embargo, muchos programas nuevos son el resultado de debates entre las partes interesadas. En lugar de redactar un programa de control sencillo y estricto que haya tenido éxito en otros países, se establecen muchos compromisos por razones aparentemente económicas que ponen en peligro los esfuerzos de control desde el principio. Los ejemplos típicos son regulaciones poco claras o inexistentes con respecto al destino del ganado PI, disposiciones laxas o inexistentes para las restricciones de movimiento y bioseguridad, y la falta de reglas de cuarentena. Tales deficiencias garantizan una larga duración del programa, altos costes y resultados deficientes, e incluso el fracaso. Los programas voluntarios exitosos requerirían una fuerte determinación por parte de todos los interesados. Idealmente, un grupo directivo formado por los actores clave de cada una de las partes interesadas debería facilitar la comunicación con los ganaderos y coordinar las medidas de formación y control. A lo largo del programa, los esfuerzos deben ser medidos y la gestión de datos es importante. En algunos países, las bases de datos de ganado existentes se utilizaron con éxito para apoyar el control de BVD. Los obstáculos son la poca visibilidad del daño causado en muchos rebaños por la BVD endémica, la complejidad del programa, la larga duración y los altos costes de los programas. Los mensajes claros y sencillos, así como la presión de los propios ganaderos, pueden ayudar a mantener la motivación y el entusiasmo de las partes interesadas. El veterinario de la explotación juega un papel importante en este contexto. Dos aspectos particularmente críticos de los enfoques voluntarios son el reto de reclutar al 100% de los ganaderos para que se inscriban y la grave amenaza que representan para los rebaños participantes no vacunados las granjas vecinas infectadas. La mayoría de los programas voluntarios, si no todos, tienen una duración prolongada, son costosos y progresan con relativa lentitud. En consecuencia, en la parte final estos programas, a menudo, se convierten en programas obligatorios impulsados por el gobierno.
Por el contrario, los programas obligatorios de control sistemático de la BVD impulsados por la legislación hasta ahora han sido muy eficaces, como se ha demostrado en varios países europeos. Como ocurre con todos los programas, los planes obligatorios también requieren una comunicación profesional y un alto nivel de concienciación y motivación por parte de todas las partes interesadas. Su principal ventaja es que todos los ganaderos están obligados a participar. Sin embargo, al igual que con los enfoques voluntarios, también necesita un apoyo total de las partes interesadas, y la falta de cumplimiento puede causar serios contratiempos y retrasos.
Además de la complejidad del proceso de control, la falta de incentivos comerciales en el pasado también es culpable del lento progreso en Europa. Durante mucho tiempo en los esfuerzos de control de la BVD, no hubo regulaciones comerciales internacionales vigentes con respecto a BVD. El Código Terrestre de la OIE todavía no tiene un capítulo sobre el control de la BVD y las normas comerciales correspondientes y, en la UE, las únicas normas relacionadas con la BVD se limitaban a los gametos. Esto ha cambiado con la introducción de la Ley europea de sanidad animal[20]. Por primera vez, la BVD se incluye como una enfermedad de categoría C para el control opcional y en el Reglamento Delegado de la Comisión[21] se establecen disposiciones sobre los programas de control y la concesión y el mantenimiento del estatus de libre de enfermedad. Estas son similares a las reglas “antiguas” para las enfermedades de la lista, por ejemplo, la leucosis bovina, con respecto a los artículos 9 y 10[22]. Con respecto al diagnóstico de laboratorio de la BVD, la legislación actual de la UE se refiere al “Manual de Pruebas de Diagnóstico y Vacunas para los Animales Terrestres de la OIE”[23]. El control de BVD en los Estados miembros o zonas se describe detalladamente en la Parte VI del Reglamento (UE) 2020/689[21]. La Comisión podrá autorizar programas de control de BVD para Estados miembros o zonas y otorgará el estatus de libre de BVD. Las autoridades competentes podrán otorgar o retirar el estatus de libre de BVD a las explotaciones ganaderas. Con respecto al comercio con ganado, el proveedor debe otorgar garantías adicionales según el estado de destino. Sin embargo, dado que existe cierta heterogeneidad en el diseño de los programas de control, se debe comprobar la probabilidad de ausencia de infección para asegurar el comercio[24]. En los Estados miembros o zonas libres de BVD, la vacunación está prohibida.
5. Conclusiones
Durante las últimas tres décadas, ha surgido un camino claro hacia el control exitoso de BVD. Siempre que haya voluntad política, un fuerte apoyo de las partes interesadas y la aplicación de métodos probados, el control de esta enfermedad económicamente importante ya no debería ser un problema. Con el nuevo marco legislativo, cabe esperar que el control de la BVD en Europa cobre impulso en los próximos años.
Referencias
1. Olafson, P.; Maccallum, A.D.; Fox, F.H. An apparently new transmissible disease of cattle. Cornell Vet. 1946, 36, 205–213.
2. Rebhun, W.C.; French, T.W.; Perdrizet, J.A.; Dubovi, E.J.; Dill, S.G.; Karcher, L.F. Thrombocytopenia Associated With Acute Bovine Virus Diarrhea Infection in Cattle. J. Vet. Intern. Med. 1989, 3, 42–46.
3. Bolin, S.R.; McClurkin, A.W.; Cutlip, R.C.; Coria, M.F. Severe clinical disease induced in cattle persistently infected with
noncyto-pathic bovine viral diarrhea virus by superinfection with cytopathic bovine viral diarrhea virus. AMJ Vet. Res. 1985, 46, 573–576.
4. Brownlie, J.; Clarke, M.C.; Howard, C.J. Experimental production of fatal mucosal disease in cattle. Vet. Rec. 1984, 114,
535–536.
5. Niskanen, R.; Emanuelson, U.; Sundberg, J.; Larssond, B.; Alenius, S. Effects of infection with bovine virus diarrhoea virus on health and reproductive performance in 2 13 dairy herds in one county in Sweden. Prev. Vet. Med. 1995, 23, 229–237.
6. Richter, V.; Bakran-Lebl, K.; Baumgartner, W.; Obritzhauser, W.; Käsbohrer, A.; Pinior, B. A systematic worldwide review of the direct monetary losses in cattle due to bovine viral diarrhoea virus infection. Vet. J. 2017, 220, 80–87.
7. Yarnall, M.J.; Thrusfield, M.V. Engaging veterinarians and farmers in eradicating bovine viral diarrhoea: A systematic review of economic impact. Vet. Rec. 2017, 181, 347
8. Gottschalk, E.E.; Greiser-Wilke, I.; Liess, B.; Moennig, V.; Frey, H.-R. An Antigen Capture Test for the Detection of Cattle Viremic with Bovine Viral Diarrhoea Virus—A Comparison with BVD Virus Isolation from Buffy Coat Cells in Bovine Kidney Cells. J. Veter Med. Ser. B 1992, 39, 467–472.
9. Flebbe, U.; Mehrkens, L. BVD/MD and its control in Lower Saxony (after the support of the Lower Saxony animal epidemic fund). DTW. Dtsch. Tierarztl. Wochenschr. 1992, 99, 217–220.
10. Houe, H.; Lindberg, A.; Moennig, V. Test strategies in bovine viral diarrhea virus control and eradication campaigns in Europe. J. Vet. Diagn. Investig. 2006, 18, 427–436.
11. Valle, P.S.; Skjerve, E.; Martin, S.W.; Larssen, R.B.; Osteras, O.; Nyberg, O. Ten years of bovine virus diarrhoea virus (BVDV) con-trol in Norway: A cost-benefit analysis. Prev. Vet. Med. 2005, 72, 189–207.
12. Marschik, T.; Obritzhauser, W.; Wagner, P.; Richter, V.; Mayerhofer, M.; Egger-Danner, C.; Käsbohrer, A.; Pinior, B. A cost-benefit analysis and the potential trade effects of the bovine viral diarrhoea eradication programme in Styria, Austria. Vet. J. 2018, 231, 19–29.
13. Evans, C.A.; Pinior, B.; Larska, M.; Graham, D.; Schweizer, M.; Guidarini, C.; DeCaro, N.; Ridpath, J.; Gates, M.C. Global knowledge gaps in the prevention and control of bovine viral diarrhoea (BVD) virus. Transbound. Emerg. Dis. 2019, 66, 640–652.
14. Stalder, H.; Hug, C.; Zanoni, R.; Vogt, H.R.; Peterhans, E.; Schweizer, M.; Bachofen, C. A nationwide database linking information on the hosts with sequence data of their virus strains: A useful tool for the eradication of bovine viral diarrhea (BVD) in Switzer-land. Virus Res. 2016, 218, 49–56.
15. Kaiser, V.; Nebel, L.; Schüpbach-Regula, G.; Zanoni, R.G.; Schweizer, M. Influence of border disease virus (BDV) on serological surveillance within the bovine virus diarrhea (BVD) eradication program in Switzerland. BMC Vet. Res. 2016, 13, 1–13.
16. Casaubon, J.; Vogt, H.-R.; Stalder, H.; Hug, C.; Ryser-Degiorgis, M.-P. Bovine viral diarrhea virus in free-ranging wild ruminants in Switzerland: Low prevalence of infection despite regular interactions with domestic livestock. BMC Vet. Res. 2012, 8, 204.
17. Frölich, K.; Thiede, S.; Kozikowski, T.; Jakob, W. A Review of Mutual Transmission of Important Infectious Diseases between Livestock and Wildlife in Europe. Ann. N. Y. Acad. Sci. 2002, 969, 4–13.
18. Schweizer, M.; Stalder, H.; Haslebacher, A.; Grisiger, M.; Schwermer, H.; Di Labio, E. Eradication of Bovine Viral Diarrhoea (BVD) in Cattle in Switzerland: Lessons Taught by the Complex Biology of the Virus. Front. Vet. Sci. 2021, 8, 1012.
19. Wernike, K.; Gethmann, J.; Schirrmeier, H.; Schröder, R.; Conraths, F.J.; Beer, M. Six Years (2011–2016) of Mandatory Nationwide Bovine Viral Diarrhea Control in Germany—A Success Story. Pathogens 2017, 6, 50.
15. Kaiser, V.; Nebel, L.; Schüpbach-Regula, G.; Zanoni, R.G.; Schweizer, M. Influence of border disease virus (BDV) on serological surveillance within the bovine virus diarrhea (BVD) eradication program in Switzerland. BMC Vet. Res. 2016, 13, 1–13.
16. Casaubon, J.; Vogt, H.-R.; Stalder, H.; Hug, C.; Ryser-Degiorgis, M.-P. Bovine viral diarrhea virus in free-ranging wild ruminants in Switzerland: Low prevalence of infection despite regular interactions with domestic livestock. BMC Vet. Res. 2012, 8, 204.
17. Frölich, K.; Thiede, S.; Kozikowski, T.; Jakob, W. A Review of Mutual Transmission of Important Infectious Diseases between Livestock and Wildlife in Europe. Ann. N. Y. Acad. Sci. 2002, 969, 4–13.
18. Schweizer, M.; Stalder, H.; Haslebacher, A.; Grisiger, M.; Schwermer, H.; Di Labio, E. Eradication of Bovine Viral Diarrhoea (BVD) in Cattle in Switzerland: Lessons Taught by the Complex Biology of the Virus. Front. Vet. Sci. 2021, 8, 1012.
19. Wernike, K.; Gethmann, J.; Schirrmeier, H.; Schröder, R.; Conraths, F.J.; Beer, M. Six Years (2011–2016) of Mandatory Nationwide Bovine Viral Diarrhea Control in Germany—A Success Story. Pathogens 2017, 6, 50.
20. Anonymous. (EU) 2016/429 EU Animal Health Law. Off. J. Eur. Union 2016, L84, 1–208.
21. Anonymous. (EU) 2020/689 Supplement EU Animal Health Law. Off. J. Eur. Union 2019, L174, 211–340.
22. Anonymous. (64/432/EEC) COUNCIL DIRECTIVE of 26 June 1964 on animal health problems affecting intra-Community trade in bovine animals and swine. Off. J. Eur. Communities 1964, 64, 164–184.
23. Kirkland, P. Bovine Viral Diarrhoea; OIE Terrestrial Manual; Office International des Épizooties: Paris, France, 2018.
24. Van Roon, A.M.; Santman-Berends, I.; Graham, D.; More, S.J.; Nielen, M.; Madouasse, A.; Mercat, M.; Fourichon, C.; Gethmann, J.; Frössling, J.; et al. STOC Free: An Innovative Framework to Compare Probability of Freedom From Infection in Heterogeneous Control Programmes. Front. Vet. Sci. 2019, 6, 133.
Este artículo es un resumen y adaptación del trabajo original publicado, bajo el título de “The Long Journey to BVD Eradication”, en la revista Pathogens 2021, 10, 1292. https://doi.org/10.3390/pathogens10101292










